-
Compteur de contenus
17 -
Inscription
-
Dernière visite
Tout ce qui a été posté par mateurfv
-

CC, besoin d'aide pour exo de programation basique
mateurfv a répondu à un(e) sujet de mateurfv dans Informatique
ahhhh -
Bonjour, j'ai vraiment bensoin d'aide pour ce devoir sur scrach et phyton. C'est rapide a faire (QCM) mais je n'ai jamais fais de la programation. En plus je dois le rendre avant demain (Je suis au cned). SVPCe link c'est le devoir: C:/Users/mateu/Downloads/0-NI16-DV-WB-01-19_Seq02_01%20(10).pdf MERCIII
-
et si c'est égale a 0,4? (N-O) pour le reste j'ai mis ça 1. Les liaisons polarisées sont: H-O ; C-N ; 2. Les solvants qui peuvent être utilisés sont L’Ether diéthylique et le Dichlorométhane car la molécule à extraire doit être la plus soluble possible dans le solvant extracteur mais le solvant extracteur ne doit pas être miscible avec l'eau. 3. Position relative des phases aqueuse et organique
-
L'exercise n 1 je veut dire que sur la photo se ne sais pas dire quelles sont les liaisons polariseés
-
pour l'exo1 tu ma enfin fait comprendre 😀 mais quant il y a rien d'ecris c'est quoi? c'est du C plus de l'H?
-
A. Les micelles Justifier les affirmations suivantes concernant les molécules tensioactives : 1. Quand on en ajoute seulement un peu dans l’eau, elles se positionnent à la surface avec leurs parties hydrophobe hors de l’eau. 2. Quand on ajoute une grande quantité de molécules tensioactives, elles forment ce que l’on appelle des micelles : elles se regroupent sous forme de sphères, dont la surface est composée uniquement des parties hydrophiles des molécules tensioactives, alors que l’intérieur est composé uniquement des parties hydrophobes des molécules. 3. Quand des micelles de tensioactifs sont présentes dans de l’eau (c’est de l’eau savonneuse), les molécules de graisse que cette eau va rencontrer vont pouvoir être dissoutes, et se retrouver à l’intérieur même des micelles.
-
Exercice 4 : Lait démaquillant (6 points) A. Les micelles Justifier les affirmations suivantes concernant les molécules tensioactives : 1. Quand on en ajoute seulement un peu dans l’eau, elles se positionnent à la surface avec leurs parties hydrophobe hors de l’eau. (1,0 point) 2. Quand on ajoute une grande quantité de molécules tensioactives, elles forment ce que l’on appelle des micelles : elles se regroupent sous forme de sphères, dont la surface est composée uniquement des parties hydrophiles des molécules tensioactives, alors que l’intérieur est composé uniquement des parties hydrophobes des molécules. (1,0 point) 3. Quand des micelles de tensioactifs sont présentes dans de l’eau (c’est de l’eau savonneuse), les molécules de graisse que cette eau va rencontrer vont pouvoir être dissoutes, et se retrouver à l’intérieur même des micelles. (1,0 point) (1,0 point
-
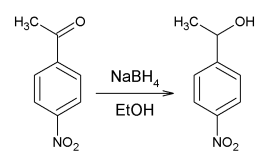
bonjour, j'ai besoin d'aide pour l'exercice 3 de ce devoir mis en fichiers a joindre Dans un laboratoire, on synthétise en milieu aqueux, du para-nitrophénylméthylcarbinol selon l’équation suivante : NaBH4 -> EtOH Protocole de l’extraction du para-nitrophénylméthylcarbinol du mélange réactionnel Une fois la synthèse effectuée été le mélange revenu à température ambiante, le transvaser dans une ampoule à décanter. Ajouter 30 mL de solvant d’extraction, mélanger, décanter et extraire la phase aqueuse. Laver avec une solution saturée de chlorure de sodium. Sécher sur sulfate de magnésium anhydre, filtrer sur papier plissé puis évaporer le solvant sous pression réduite. Après séchage, une masse m = 1,99 g de para-nitrophénylméthylcarbinol est obtenue. Données Solubilité du para-nitrophénylméthylcarbinol dans différents solvants Eau (d = 1,0) peu soluble Ethanol (d = 0,79) soluble Ether diéthylique (d = 0,71) très soluble Dichlorométhane (d = 1,33) très soluble Cyclohexane (d = 0,78) très faible Miscibilité des solvants d’extraction avec l’eau Ethanol (d = 0,79) miscible Ether diéthylique (d = 0,71) non miscible Dichlorométhan e (d = 1,33) non miscible Cyclohexane (d = 0,78) non miscible 1. Le para-nitrophénylméthylcarbinol est une molécule polaire. Quelles sont les liaisons polarisées ? (1,0 point) 2. Dans le protocole, le solvant d’extraction n’est pas précisé. Quel(s) solvant(s) peut (peuvent) être utilisés ? Justifier votre réponse en utilisant les tableaux de données. (1,0 point) 3. Préciser sur un schéma la position relative des phases aqueuse et organique. (1,0 point) 4. À quoi sert le lavage de la phase organique avec une solution saturée de chlorure de sodium ? (1,0 point)
-
daccord, mais j'ai pas compris
-
MERCIIIIIIIIIIIIIIIIIIIIIIIIIIIIII mais je mais exactement ce que tu a écris?
-
Exercice 4 : Lait démaquillant (6 points) A. Les micelles Justifier les affirmations suivantes concernant les molécules tensioactives : 1.Exercice 4 : Lait démaquillant (6 points) A. Les micelles Justifier les affirmations suivantes concernant les molécules tensioactives : 1. Quand on en ajoute seulement un peu dans l’eau, elles se positionnent à la surface avec leurs parties hydrophobe hors de l’eau. (1,0 point) 2. Quand on ajoute une grande quantité de molécules tensioactives, elles forment ce que l’on appelle des micelles : elles se regroupent sous forme de sphères, dont la surface est composée uniquement des parties hydrophiles des molécules tensioactives, alors que l’intérieur est composé uniquement des parties hydrophobes des molécules. (1,0 point) 3. Quand des micelles de tensioactifs sont présentes dans de l’eau (c’est de l’eau savonneuse), les molécules de graisse que cette eau va rencontrer vont pouvoir être dissoutes, et se retrouver à l’intérieur même des micelles. (1,0 point) (1,0 point)
-
Exercice 3 : Réduction en synthèse organique (4 points) Dans un laboratoire, on synthétise en milieu aqueux, du para-nitrophénylméthylcarbinol selon l’équation suivante : Protocole de l’extraction du para-nitrophénylméthylcarbinol du mélange réactionnel Une fois la synthèse effectuée été le mélange revenu à température ambiante, le transvaser dans une ampoule à décanter. Ajouter 30 mL de solvant d’extraction, mélanger, décanter et extraire la phase aqueuse. Laver avec une solution saturée de chlorure de sodium. Sécher sur sulfate de magnésium anhydre, filtrer sur papier plissé puis évaporer le solvant sous pression réduite. Après séchage, une masse m = 1,99 g de para-nitrophénylméthylcarbinol est obtenue. Données Solubilité du para-nitrophénylméthylcarbinol dans différents solvants Eau (d = 1,0) Ethanol (d = 0,79) Ether diéthylique (d = 0,71) Dichlorométhane (d = 1,33) Cyclohexane (d = 0,78) peu soluble soluble très soluble très soluble très faible Miscibilité des solvants d’extraction avec l’eau Ethanol (d = 0,79) Ether diéthylique (d = 0,71) Dichlorométhan e (d = 1,33) Cyclohexane (d = 0,78) miscible non miscible non miscible non miscible 1. Le para-nitrophénylméthylcarbinol est une molécule polaire. Quelles sont les liaisons polarisées ? (1,0 point) 2. Dans le protocole, le solvant d’extraction n’est pas précisé. Quel(s) solvant(s) peut (peuvent) être utilisés ? Justifier votre réponse en utilisant les tableaux de données. (1,0 point) 3. Préciser sur un schéma la position relative des phases aqueuse et organique. (1,0 point) 4. À quoi sert le lavage de la phase organique avec une solution saturée de chlorure de sodium ? (1,0 point)
-
t'a reusi a le faire?????!